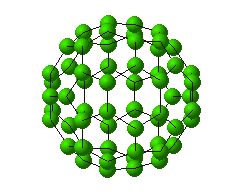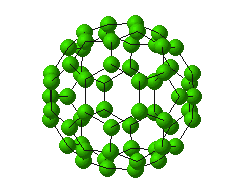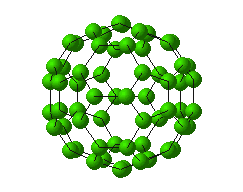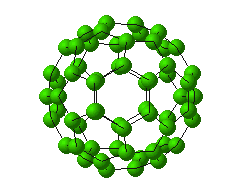|
گزارش كار درباره وبلاگ به وبلاگ من خوش آمدید آخرین مطالب
آرشيو وبلاگ نويسندگان
عمل ذوب گرماگیر است لذا تا زمانی که تمامی جسم ذوب نشده است دمای آن تغییر نمیکند و گرمای داده شده به جسم صرف تغییر حالت آن میگردد . این گرما راگرمای نهان ذوب مینامند . پدیده ی ذوب وقتی روی میدهد که انرژی گرمایی بر نیروهای بین مولکولی که ذرات را در حالت جامد نگه میدارند فایق آید . نقطه ذوب یک ترکیب دمایی است که در آن جسم به صورت مایع در می آید . در این دما فشار بخار مایع و فشار بخار جامد برابرند و دو فاز مایع و جامد در حال تعادل هستند . دمای ذوب یک جسم خالص در طول عمل ذوب ثابت میماند . به عبارت دیگر اگر به مخلوط مایع و جامد یک جسم خالص گرما بدهیم تا وقتی که تمام جامد به مایع تبدیل نشود دمای جسم بالا نمیرود . در تمام مدت ذوب درجه حرارت ثابت میماند و در این درجه حرارت دو فاز در حال تعادل هستند . وجود ناخالصی در یک ماده ، نقطه ذوب آنرا پایین می آورد و مخلوط دو ماده ، دارای نقطه ذوبی پایین تر از هر کدام از دو ماده اولیه است و چنانچه گرم کردن متوقف شود تا زمانی که تمامی مخلوط جامد نشده است دما پایین نمیرود . برخی از جامدات آلی در در دمای ذوب شدن یا پیش از آن بر اثر گرما تجزیه میشوند . در این صورت میتوان به جای نقطه ی ذوب دمای تجزیه را به عنوان یک خاصیت فیزیکی مورد استفاده قرار داد . بعضی از مواد فشار بخار بالایی دارند به طوریکه در نقطه ی ذوب خود یا پیش از آن تصعید میشوند . در این گونه موارد تعیین نقطه ی ذوب در لوله ی در بسته انجام میشود . گرمايي كه يك جسم جامد در نقطه ذوب خود مي گيرد تا به مايع تبدل شود ، گرماي ذوب آن جسم ناميده مي شود . دادن گرماي نهان ذوب به جامدي كه به نقطه ذوب خود رسيده است ، آنرا به طور كامل به مايع تبديل مي كند . تاثیر فشار بر نقطه ذوب: با افزایش فشار ، نقطه ذوب یخ کاهش می یابد ، به همین دلیل ، یخ ها در کوه دیرتر آب می شوند ، زیرا فشار هوا در آن محل کمتر است . تاثیر ناخالصی در نقطه ذوب یخ : ناخالصی ، نقطه ذوب یخ را کاهش می دهد . تعیین دمای ذوب: دمای ذوب را عمدتا به دو طریق زیر تعیین میکنند : ١) لوله ی تیل ٢) دستگاههای اندازه گیری دقیق میکروسکوپی لوله ی تیل : وسیله ی ساده ای است که به سهولت قابل دسترسی است . لوله ی تیل به نحوی طراحی شده است که وقتی در آن روغن می ریزیم و لوله را گرم می کنیم در آن تبادل گرمایی صورت می گیرد به نحوی که توزیع دما در سراسر روغن داخل لوله یکنواخت می شود . چنانچه لوله تیل در دسترس نباشد از یک بشر کوچک ٥٠ یا ١٠٠ میلی لیتری میتوان به عنوان حمام استفاده کرد . دستگاههای میکروسکوپی : دستگاههایی هستند که میتوانند دمای نقطه ذوب نمونه ما را به طور دقیق بیان کنند . و ما از روی دما سنج موجود در روی آن می توانیم دمای ان را بخوانیم روش ماکرو : دمای ذوب را می توان به روش ماکرو بدست آورد و ملاحظه نمود که در طول ذوب دما ثابت است . انواع دستگاههای ساده الکتریکی برای تعیین نقطه ذوب ترکیبات آلی به روش ماکرو وجود دارد . روش اینتراستریفیکاسیون: كارآيي روش اينتراستريفيكاسيون با استفاده از كاتاليزورهاي بيوشيميايي و شيميايي در كاهش نقطه ذوب روغن خوراكي مورد مطالعه قرار گرفت . در اين رابطه مخلوطي از روغن مايع آفتابگردان و روغن سوياي كاملا هيدروژنه با نسبت ٧٥:٢٥ و نقطه ذوب ٥٨ درجه سانتيگراد بعنوان مبنا انتخاب گرديد . در اينتراستريفيكاسيون با استفاده از آنزيم ليپاز نقطه ذوب تا حد ٢٤ درجه سانتيگراد و با استفاده از متيلات سديم تا حد ٣٢ درجه سانتيگراد كاهش يافت در هر دو روش روغن به دست آمده حتي در حالت جامد داراي ظاهري مطلوب و يكنواخت بود . دستگاه تعیین نقطه ذوب متلر تولیدو: بدون شك يكي از مفيد ترين اطلاعات گرمايي درمطالعه مواد جامد ، تعيين نقطه ذوب مواد مي باشد . اين متغير كاربرد فراواني در تعيين خلوص مواد و شناسايي آنها دارد . دستگاه تعيين نقطه ذوب FP62 با عملكرد سريع و آسان برنامه دمايي مورد نظر را با دقت و تكرارپذيري فراوان اجرا مي كند . پس از وارد كردن دماي ابتدايي و انتهايي و سرعت گرمايش ، با فشار يك كليد دستگاه به صورت كاملا اتوماتيك شروع به كار نموده و پس از تعيين نقطه ذوب مي توان دماي ابتدا و انتها ، سرعت گرمايش ، تاريخ ، زمان و ميزان نقطه ذوب و حتي در صورت نياز نموداري ساده را بر روي نمايشگر يا پرينتر مخصوص مشاهده نمود .براي تعيين نقطه ذوب ، يك اشعه با طول موج ثابت به نمونه تابيده ، قبل از شروع ذوب ، اشعه به فتوسل دستگاه نمي رسد ، ولي در هنگام ذوب ، اشعه از نمونه عبور نموده و به فتوسل مي تابد . دستگاه دماي اندازه گيري شده توسط سنسور دمايي ، در هنگام برخورد اشعه به فتوسل رابه عنوان نقطه ذوب معرفي مي نمايد .
شرح آزمایش وسایل و مواد مورد نیاز : قدار کمی از نمونه جامد مجهول ، یک عدد لوله مویین به طول حدود ١٠ سانتی متر ، دما سنج ، مقدار کمی چسب شیشه ای یا کش لاستیکی ، گیره و پایه ، حمام روغن یا پارافین طریقه انجام آزمایش : یک لوله ی مویین تمیز برداشته و بوسیله ی شعله یک طرف آنرا مسدود کنید . سپس چند بار نوک باز لوله مویین را آهسته به داخل جسم جامد بزنید ، با برگرداندن لوله و با زدن سریع انتهای بسته لوله بر روی یک سطح محکم میتوان جسم جامد را به طرف انتهای بسته لوله هدایت کرد . جسم باید در انتهای بسته لوله کاملا متراکم شود . بهترین راه انجام این کار آن است که در خاتمه لوله مویین را از درون یک لوله پاسکال بر روی سطح محکمی رها کنید . نمونه باید به اندازه ای باشد که پس از عمل تراکم لوله مویین را تا عمق ٣ - ٢ میلی متر پر کند . این مقدار نباید بیشتر باشد . لوله مویین را به وسیله ی کمی نوار چسب به دماسنج متصل کنید . خود نمونه باید در مجاورت حباب گرماسنج باشد و چسب شیشه ای در بالا ترین جا تا از سطح مایع داغ دور باشد . سپس دماسنج را به گیره متصل کرده و داخل حمام کنید . با استفاده از حرارت یک چراغ کوچک بونزن به آرامی درجه حرارت مایعی را که باید گرم شود بالا ببرید ( مایع حمام معمولا از پارافین ، گلی کول ، گلیسیرین ، اسید سولفوریک غلیظ که نقطه جوش بالایی دارند استفاده میشود) درجه ای را که ابتدا عمل ذوب مشاهده میشود و همچنین درجه ای را که در آن آخرین قسمت جامد ذوب میشود را یادداشت کنید . نمونه ی A دارای دامنه ی ذوب ٩٤ تا ١٣٢ درجه سانتیگراد بود و دامنه ی ذوب نمونه ی B از ١٠٠ تا ١٢٥ درجه سانتیگراد بود .
شیمی معدنی شاخهای از دانش شیمی است که با کانیها (مواد معدنی) و خواص آنها سروکار دارد. شیمی معدنی شاخه بزرگی از علم شیمی است که بطور کلی شامل بررسی، تحلیل و تفسیر نظریههای خواص و واکنشهای تمام عناصر و ترکیبات آنها بجز هیدروکربنها و اغلب مشتقات آنهاست. به عبارت دیگر میتوان چنین اظهار نظر کرد که شیمی معدنی کلیه موادی که از جمله ترکیبات کربن نباشند، به استثنای اکسیدهای کربن و دی سولفید کربن را دربر میگیرد.
نگاه کلیدر شیمی معدنی در مورد گستره وسیعی از موضوعات از جمله: ساختمان اتمی، بلورنگاری (کریستالوگرافی)، انواع پیوندهای شیمیایی اعم از پیوندهای کووالانسی، یونی، هیدروژنی و ...، ترکیبات کوئوردیناسیون و نظریههای مربوطه از جمله نظریه میدان بلور و نظریه اوربیتال مولکولی، واکنشهای اسید و باز، سرامیکها، تقارن مولکولی و انواع بخشهای زیرطبقه الکتروشیمی (برقکافت، باطری، خوردگی، نیمه رسانایی و غیره) بحث میشود. در باب اهمیت شیمی معدنی، ساندرسن چنین نوشته است: در واقع بیشترین مباحث علم شیمی را دانش اتمها تشکیل میدهد و کلیه خواص مواد و ترکیبات، به ناچار ناشی از نوع اتمها و روشی است که با توجه به آن، اتمها به یکدیگر میپیوندند و مجموعه تشکیل میدهند و از طرف دیگر کلیه تغییرات شیمیایی متضمن بازآرایی اتمهاست. در این حال شیمی معدنی تنها بخشی از علم شیمی است که با توجه به آن میتوان به صورتی ویژه، در باب مغایرتهای موجود در میان کلیه انواع اتمها بررسی نمود. طبقه بندی مواد معدنیدر یک مفهوم گسترده، مواد معدنی را میتوان در چهار طبقه تقسیم بندی نمود: عناصر، ترکیبات یونی، ترکیبات مولکولی و جامدات شبکهای یا بسپارها. عناصر: عناصر دارای ساختارها و خواص بسیار متفاوت هستند. بنابراین میتوانند به یکی از صورتهای زیر باشند:
{O_2 , H_2})
{C_6 , S_8 , P_4})
{MgAl_2O_4})، سیلیکاتهای مختلف مانند Latex Error: {CaMg(SiO_3)_2} و ...
{Ni(H_2O)_6{2+} , Co(NH_3)_6{3+} , SiF_6^{2-}} .
{UF_6 , OsO_4 , SO_2 , PF_3} .
{RuH(CO_2Me)(PPh_3)_3 , PtCl2(PMe_3)_2} .
{Zr(Cn_2C_6H_5)_4 , Ni(CO)_4} .
{YBa_2Cu_3O_7} است. ساختارهای مواد معدنیساختار بسیاری از مواد آلی از چهار وجهی مشتق میشود. فراوانی آنها به این دلیل است که در مواد آلی ساده، بیشترین ظرفیت کربن و همچون بیشتر عناصر دیگری (به استثنای هیدروژن) که معمولاً به کربن پیوند میشوند، چهار است. اما اجسام معدنی وضعیت ساختاری بسیار پیچیدهای دارند، زیرا اتمها ممکن است خیلی بیشتر از چهار پیوند تشکیل دهند. بنابراین، در مواد معدنی اینکه اتمها پنج، شش، هفت، هشت و تعداد بیشتری پیوند تشکیل دهند، امری عادی است. پس تنوع شکل هندسی در مواد معدنی خیلی بیشتر از مواد آلی است. ساختار مواد معدنی اغلب بر اساس تعدادی از دو وجهیهای با نظم کمتر، نظیر دو هرمی با قاعده مثلث، منشور سه ضلعی و غیره و همچنین بر اساس شکلهای باز چند وجیهای منتظم یا غیر منتظم که در آنها یک یا چند راس حذف شده است، نیز مشاهده میشود. انواع واکنشهای مواد معدنیدر بیشتر واکنشهای آلی میتوانیم در مورد مکانیسمی که واکنش از طریق آن انجام میشود، بحث و بررسی کنیم، در صورتی که برای بسیاری از واکنشهای معدنی فهم دقیق مکانیسم غیر ممکن یا غیر ضروری است. این امر دو دلیل عمده دارد: رابطه شیمی فیزیک و شیمی معدنیدر توجیه موجودیت مواد معدنی و در توصیف رفتار آنها، به استفاده از جنبههای خاصی از شیمی فیزیک، بخصوص ترمودینامیک، ساختارهای الکترونی اتمها، نظریههای تشکیل پیوند در مولکولها، سینتیک واکنش و خواص فیزیکی مواد نیاز داریم. بنابراین با استفاده از شیمی فیزیک میتوان به ساختار اتمی و مولکولی، تشکیل پیوند شیمیایی و دیگر اصول لازم برای درک ساختار و خواص مواد معدنی پرداخت. شیمی فیزیک (Physical chemistry) بخشی از علم شیمی است که در آن ، از اصول و قوانین فیزیکی ، برای حل مسائل شیمیایی استفاده میشود. به عبارت دیگر ، هدف از شیمی فیزیک ، فراگیری اصول نظری فیزیک در توجیه پدیدههای شیمیایی است. برای آشنایی بیشتر با علم شیمی فیزیک ، باید با زیر مجموعههای این علم آشنا شویم و اهداف این علم را در دل این زیر مجموعهها بیابیم. ترمودینامیک شیمیاییتعیین سمت و سوی واکنشترمودینامیک شیمیایی در عمل ، برقراری چهارچوبی برای تعیین امکان پذیربودن یا خود به خود انجام شدن تحولی فیزیکی یا شیمیایی معین است. به عنوان مثال ، ممکن است به حصول معیاری جهت تعیین امکان پذیر بودن تغییری از یک فاز به فاز دیگر بطور خود به خود مانند تبدیل گرافیت به الماس یا با تعیین سمت و سوی خود به خود انجام شدن واکنشی زیستی که در سلول اتفاق میافتد، نظر داشته باشیم.در حلاجی این نوع مسائل ، چند مفهوم نظری و چند تابع ریاضی دیگر بر مبنای قوانین اول و دوم ترمودینامیک و برحسب توابع انرژی گیبس ابداع شدهاند که شیوههای توانمندی برای دستیابی به پاسخ آن مسائل ، در اختیار قرار دادهاند. تعادلپس از تعیین شدن سمت و سوی تحولی طبیعی ، ممکن است علم بر میزبان پیشرفت آن تا رسیدن به تعادل نیز مورد توجه باشد. به عنوان نمونه ، ممکن است حداکثر راندمان تحولی صنعتی یا قابلیت انحلال دیاکسید کربن موجود در هوا ، در آبهای طبیعی یا تعیین غلظت تعادلی گروهی از متابولیتها ( Metabolites ) در یک سلول مورد نظر باشد. روشهای ترمودینامیکی ، روابط ریاضی لازم برای محاسبه و تخمین چنین کمیتهایی را بدست میدهد.گرچه هدف اصلی در ترمودینامیک شیمیایی ، تجزیه و تحلیل در بررسی امکان خود به خود انجام شدن یک تحول و تعادل میباشد، ولی علاوه بر آن ، روشهای ترمودینامیکی به بسیاری از مسائل دیگر نیز قابل تعمیم هستند. مطالعه تعادلهای فاز ، چه در سیستمهای ایده آل و چه در غیر آن ، پایه و اساس کار برای کاربرد هوشمندانه روشهای استخراج ، تقطیر و تبلور به عملیات متالوژی و درک گونههای کانیها در سیستمهای زمین شناسی میباشد. تغییرات انرژیهمین طور ، تغییرات انرژی ، همراه با تحولی فیزیکی یا شیمیایی ، چه به صورت کار و چه به صورت گرما مورد توجه جدی قرار دارند؛ این تحول ممکن است احتراق یک سوخت ، شکافت هسته اورانیوم یا انتقال یک متابولیت در بستر گرادیان غلظت باشد.مفاهیم و روشهای ترمودینامیکی ، نگرشی قوی برای درک چنان مسائلی را فراهم می آورد که در شیمی فیزیک مورد بررسی قرار میگیرند. 
الکتروشیمیتمام واکنشهای شیمیایی ، اساسا ماهیت الکتریکی دارند؛ زیرا الکترونها ، در تمام انواع پیوندهای شیمیایی (به راههای گوناگون) دخالت دارد. اما الکتروشیمی ، بیش ار هر چیز بررسی پدیده های اکسایش- کاهش (Oxidation - Reduction) است. روابط بین تغییر شیمیایی و انرژی الکتریکی ، هم از لحاظ نظری و هم از لحاظ عملی حائز اهمیت است.از واکنشهای شیمیایی میتوان برای تولید انرژی الکتریکی استفاده کرد، (در سلولهایی که "سلولها یا پیلهای ولتایی" یا "سلولهای گالوانی" نامیده میشوند) و انرژی الکتریکی را میتوان برای تبادلات شیمیایی بکار برد (در سلولهای الکترولیتی). علاوه بر این، مطالعه فرایندهای الکتروشیمیایی منجر به فهم و تنظیم قواعد آن گونی از پدیده های اکسایش- کاهش که خارج از این گونه سلولها یا پیلها روی می دهد نیز میشود. سینتیک شیمیایی (Chemical Kinetic)سینتیک شیمیایی عبارت از بررسی سرعت واکنشهای شیمیایی است. سرعت یک واکنش شیمیایی را عوامل معدودی کنترل میکنند. بررسی این عوامل ، راههایی را نشان میدهد که در طی آنها ، مواد واکنشدهنده به محصول واکنش تبدیل میشوند. توضیح تفضیلی مسیر انجام واکنش بر مبنای رفتار اتمها ، مولکولها و یونها را "مکانیسم واکنش" مینامیم.در ترمودینامیک و الکتروشیمی ، کارها پیشبینی انجام واکنش بود؛ اما مشاهدات صنعتی ، نتایج ترمودینامیک شیمیایی را به نظر تایید نمیکند. در این حالت نبایستی فکر کنیم که پیش بینی ترمودینامیک اشتباه بوده است؛ چون ترمودینامیک کاری با میزان پیشرفت واکنش و نحوه انجام فرایندها ندارد. نظر به اهمیت انجام فرایندها از نظر بهره زمانی ، لازم است که عامل زمان در بررسی فرایندها وارد شود. به عنوان مثال ، کاتالیزورهای بخصوصی به نام "آنزیمها" در تعیین این که کدام واکنش در سیستمهای زیستی با سرعت قابل ملاحظه به راه بیافتد، عواملی مهم هستند. مثلا مولکول "تری فسفات آدنوزین" (Adnosine triphosphate) از لحاظ ترمودینامیکی در محلولهای آبی ناپایدار بوده و باید هیدرولیز گردیده و به "دی فسفات آدنوزین" و یک فسفات معدنی تجزیه شود. در صورتی که این واکنش در غیاب آنزیمی ویژه ، "آدنوزین تری فسفاتاز" ، بسیار کند میباشد. در واقع همین کنترل ترمودینامیکی سمت و سوی واکنشها به همراه کنترل سرعت آنها توسط آنزیمهاست که موجودیت سیستمی با تعادل بسیار ظریف ، یعنی سلول زنده را مقدور میسازد. بیشتر واکنشهای شیمیایی طی مکانیسمهای چند مرحلهای صورت میگیرند. هرگز نمیتوان اطمینان داشت که یک مکانیسم پیشنهاد شده ، بیانگر واقعیت باشد. مکانیسم واکنشها تنها حدس و گمانهایی بر اساس بررسیهای سینتیکیاند. ارتباط شیمی فیزیک با سایر علومهمانطور که عنوان شد و از نام شیمی فیزیک پیداست، این علم ، مسائل و پدیدههای شیمیایی را با اصول و قوانین فیزیک توجیه میکند و ارتباط تنگاتنگی میان شیمی و فیزیک برقرار میکند. علاوه بر آن ، روابط بسیار پیچیده شیمیایی با زبان ریاضی ، مرتب و طبقهبندی شده و قابل فهم میگردد. بسیاری از پدیدههای زیستی مانند سوخت و ساز مواد غذایی در سلولهای بدن با علم شیمی فیزیک توجیه میشود و این ، ارتباط شیمی فیزیک را با زیست شناسی و به تبع آن پزشکی بیان میکند.بسیاری از پدیده های طبیعی که به صورت خود به خودی انجام میگیرد، همانند تبدیل خود به خودی الماس به گرافیت ، با علم شیمی فیزیک توجیه میشود. 
کاربردهای شیمی فیزیکارتباط شیمی فیزیک با سایر علوم ، کاربردهای اقتصادی و اجتماعی این علم را بیان میکند. به عنوان مثال ، با مطالعه الکتروشیمی ، به پایه و اساس پدیدههای طبیعی مانند خوردگی فلزات پی برده و میتوان از ضررهای اقتصادی و اجتماعی چنین پدیدههایی جلوگیری کرده و یا این پدیدهها را به مسیری مفید برای جامعه سوق داد. علاوه بر آن ، کاربرد قوانین ترمودینامیک مانند "نقطه اتکیتک" در جلوگیری از ضررهای جانی و مالی پدیدههای طبیعی مانند یخ بندان بعد از بارش برف ، بسیار مفید میباشد (مخلوط کردن برف و نمک بر اساس نقطه اتکیتک).فراموش نکنیم که تمامی باطریها و پیلهایی که وسایل زندگی ما با نیروی آنها بکار گرفته میشوند، براساس قوانین شیمی فیزیک ساخته شدهاند
تاریخچهواژه غلط انداز " آلی " باقیمانده از روزگاری است که ترکیبهای شیمیایی را ، بسته به این که از چه محلی منشاء گرفته باشند، به دو طبقه غیر آلی و آلی تقسیم میکردند. ترکیبهای غیر آلی ، ترکیبهایی بودند که از مواد معدنی بدست میآمدند. ترکیبات آلی ، ترکیبهایی بودند که از منابع گیاهی یا حیوانی ، یعنی از مواد تولید شده به وسیله ارگانیسمهای زنده بدست میآمدند.در حقیقت تا حدود سال 1950، بسیاری از شیمیدانها تصور میکردند که ترکیبات آلی باید در ارگانیسم های زنده بوجود آیند و در نتیجه ، هرگز نمیتوان آنها را از مواد غیر آلی تهیه کرد. ترکیبهایی که از منابع آلی بدست می آمدند، یک چیز مشترک داشتند: همه آنها دارای عنصر کربن بودند. حتی بعد از آن که روشن شد این ترکیبها الزاما نباید از منابع زنده به دست آیند، بلکه میتوان آنها را در آزمایشگاه نیز تهیه کرد. بهتر آن دیدند که برای توصیف آنها و ترکیبهایی مانند آنها ، همچنان از واژه آلی استفاده کنند. تقسیم ترکیبها به غیر آلی و آلی تا به امروز همچنان محفوظ مانده است. 
منابع مواد آلیامروزه گرچه هنوز مناسبتر است که بعضی از ترکیبهای کربن را از منابع گیاهی و حیوانی استخراج کنند، ولی بیشتر آنها را میسازند. این ترکیبها را گاهی از اجسام غیر آلی مانند کربناتها و سیانیدها میسازند، ولی اغلب آنها را از سایر ترکیبهای آلی بدست میآورند. دو منبع بزرگ مواد آلی وجود دارد که ترکیبهای آلی ساده از آن بدست میآیند:نفت و زغال سنگ؛ (هر دو منبع به معنی قدیمی خود ، آلیاند، زیرا فرآورده های تجزیه و فساد گیاهان و جانوران به شمار می آیند). این ترکیبهای ساده بعنوان مواد ساختمانی اولیه مورد استفاده قرار میگیرند و با کمک آنها میتوان ترکیبهایی بزرگتر و پیچیدهتر را تهیه کرد. با نفت و زغال سنگ بعنوان سوختهای فسیلی ، باقیمانده از هزاران سال و تجدید نشدنی ، آشنا هستیم. این منابع ، بویژه نفت ، بمنظور تامین نیازهای پیوسته رو به افزایش ما به انرژی ، با سرعتی نگرانکننده مصرف میشوند. امروزه ، کمتر از ده درصد نفت مصرفی در تهیه مواد شیمیایی ، بکار گرفته میشود. بیشتر آن برای تامین انرژی بسادگی سوزانده میشود. خوشبختانه ، منابع دیگر انرژی ، مانند خورشیدی ، زمین گرمایی ، باد ، امواج ، جزر و مد ، انرژی هستهای نیز وجود دارد. زیست تودهچگونه و در کجا میتوانیم منبع دیگری از مواد اولیه آلی پیدا کنیم؛ بی شک باید به جایی روی آوریم که مبدا اولیه سوختهای فسیلی است، یعنی زیست توده biomass ، ولی این بار بطور مستقیم و بدون دخالت هزاران سال. زیست توده ، تجدید شدنی است، براحتی مورد استفاده قرار میگیرد و میتواند تا موقعی که بر روی این سیاره زندگی میکنیم، تداوم داشته باشد.در ضمن عقیده بر این است که نفت خیلی گرانبهاتر از آن است که سوزانده شود. ویژگی ترکیبات کربنبراستی چه ویژگی خاصی در ترکیبهای کربن وجود دارد که لازم است آنها را از ترکیبهای یکصد و چند عنصر دیگر جدول تناوبی جدا کنیم؟ دست کم ، بخشی از پاسخ چنین است: ترکیبهای بسیار زیادی از کربن وجود دارد و مولکول آنها میتواند بسیار بزرگ و بسیار پیچیده باشد. شمار ترکیبهای کربندار ، چندین برابر ترکیبهایی است که کربن ندارند. این ترکیبهای آلی را به خانواده هایی تقسیم میکنند که معمولا در ترکیبهای غیرآلی ، همانندی برایشان وجود ندارد.بعضی از مولکولهای شناخته شده آلی ، هزاران اتم دارند و آرایش اتمها در مولکولهای نسبتا کوچک ممکن است بسیار پیچیده باشد. یکی از دشواریهای اساسی شیمی آلی ، یافتن چگونگی آرایش اتمها در مولکولها ، یعنی تعیین ساختار این ترکیبهاست. 
واکنشها در شیمی آلیراههای زیادی برای خرد کردن مولکولهای پیچیده یا نوآرایی آنها بمنظور تشکیل مولکولهای تازه وجود دارد. راههای زیادی برای افزودن اتمهای دیگر به این مولکولها یا جانشین کردن اتمهای تازه به جای اتمهای پیشین وجود دارد. بخشی ار شیمی آلی صرف دانستن این مطلب میشود که این واکنشها چه واکنشهایی هستند، چگونه انجام میشوند و چگونه میتوان از آنها در سنتز ترکیبهای مورد نیاز استفاده کرد.گستره اتصال اتمهای کربن در ترکیبات کربناتمهای کربن میتوانند به یکدیگر متصل شوند. گستره اتصال آنها به هم ، به اندازهای است که برای اتمهای هیچ یک از عناصر دیگر ممکن نیست. اتمهای کربن میتوانند زنجیرهایی به طول هزارها اتم ، یا حلقههایی با ابعاد گوناگون تشکیل دهند. این زنجیرها ممکن است شاخهدار و دارای پیوندهای عرضی باشند. به اتمهای کربن در این زنجیرها و حلقه ها ، اتمهای دیگری بویژه هیدروژن ، همچنین فلوئور ، کلر ، برم ، ید ، اکسیژن ، نیتروژن ، گوگرد ، فسفر و سایر اتمها متصل میشوند. سلولز ، کلروفیل و اکسی توسین مثالهایی از این دستند.هر آرایش متفاوتی از اتمها با یک ترکیب معین تطبیق میکند و هر ترکیب دارای مجموعه ای از ویژگیهای شیمیایی و فیزیکی مخصوص به خود است. شگفتانگیز نیست که امروزه بیش از ده میلیون ترکیب کربن میشناسیم و این که بر این تعداد ، همه ساله نیم میلیون افزوده میشود. همچنین شگفت انگیز نیست که مطالعه و بررسی شیمی آنها به تخصصی ویژه نیاز دارد. تکنولوژی و شیمی آلیشیمی آلی ، زمینهای است که از دیدگاه تکنولوژی اهمیتی فوقالعاده دارد. شیمی آلی شیمی رنگ و دارو ، کاغذ و مرکب ، رنگینه ها و پلاستیکها ، بنزین و لاستیک چرخ است. شیمی آلی ، شیمی غذایی است که میخوریم و لباسی است که میپوشیم.زیست شناسی و شیمی آلیشیمی آلی در زیست شناسی و پزشکی نقش اساسی برعهده دارد. گذشته از آن ، ارگانیسم های زنده ، بیشتر از ترکیبهای آلی ساخته شده اند. مولکولهای "زیست شناسی مولکولی" همان مولکولهای آلی هستند. زیست شناسی در سطح مولکولی ، همان شیمی آلی است.
عصر کربناگر بگوییم که در عصر کربن زندگی می کنیم، دور از حقیقت نیست. هر روز ، روزنامهها توجه ما را به ترکیبهای کربن جلب میکنند: کلسترولو چربیهای سیرنشده چند عاملی ، هورمونهای رشد و استروئیدها ، حشره کشها و فرومونها ، عوامل سرطانزا و عوامل شیمیدرمانی ، DNA و ژنها. بر سر نفت ، جنگها در گرفته است.دو فاجعه اسفانگیز ما را تهدید میکنند، هر دو از تجمع ترکیبهای کربن در اتمسفر ناشی میشوند: از بین رفتن لایه اوزون که بیشتر ناشی از کلرو فلوئورو کربنهاست و اثر گلخانهای از متان ، کلروفلوئوروکربنها و بیش از همه ، دیاکسید کربن سرچشمه میگیرد. شاید کنایه بر همین مطلب است که نشریه علوم ، برای سال 1990، بعنوان مولکول سال ، الماس را که یکی از شکلهای آلوتروپی کربن است، برگزیده. خبر دیگر ، کشف آلوتروپ جدید کربن C60 (باک منیستر فولرن) است که چنین هیجانی در جهان شیمی از زمان " ککوله " تاکنون دیده نشده بود. چهار شنبه 8 تير 1391برچسب:, :: 20:9 :: نويسنده : محمد حسن
شیمی تجزیه شامل جداسازی ، شناسایی و تعیین مقدار نسبی اجزای سازنده یک نمونه از ماده است. دید کلیشیمی تجزیه نقش حیاتی را در توسعه علوم مختلف به عهده دارد، لذا ابداع فنون جدید تجزیه و بسط و تکامل روشهای تجزیه شیمیایی موجود ، آنقدر سریع و گسترده است که اندکی درنگ در تعقیب رویدادهای تازه سبب بوجود آمدن فاصلههای بسیار زیاد علمی خواهد شد. نقش این فنون در فعالیتهای تولیدی روز به روز گستردهتر و پردامنهتر میگردد. امروزه ، کنترل کیفیت محصولات صنعتی و غیر صنعتی ، جایگاه ویژهای دارد که اساس این کنترل کیفیت را تجزیههای شیمیایی انجام شده به کمک روشهای مختلف تجزیهای تشکیل میدهد.
سیر تحولی و رشداصولا توسعه و تغییر پایدار در فنون و روشهای تجزیه وجود دارد. طراحی دستگاه بهتر و فهم کامل مکانیسم فرآیندهای تجزیهای ، موجب بهبود پایدار حساسیت ، دقت و صحت روشهای تجزیهای میشوند. چنین تغییراتی به انجام تجزیههای اقتصادیتر کمک میکند که غالبا به حذف مراحل جداسازی وقت گیر ، منجر میشوند. باید توجه داشت که اگر چه روشهای جدید تیتراسیون مانند کریوسکوپی ، Pressuremetriz ، روشهای اکسیداسیون _ احیایی و استفاده از الکترود حساس فلوئورید ابداع شدهاند، هنوز از روشهای تجزیه وزنی و تجزیه جسمی (راسب کردن ، تیتراسیون و استخراج بوسیله حلال) برای آزمایشهای عادی استفاده میشود.به هر حال در چند دهه اخیر ، تکنیکهای سریعتر و دقیقترِی بوجود آمدهاند. در میان این روشها میتوان به اسپکتروسکوپی ماده قرمز ، ماورای بنفش و اشعه X اشاره کرد که از آنها برای تشخیص و تعیین مقدار یک عنصر فلزی با استفاده از خطوط طیفی جذبی یا نشری استفاده میگردد. سایر روشها عبارتند از:
انواع تجزیهوقتی آزمایش به شناسایی یک یا چند چیز جز از یک نمونه (شناسایی مواد) محدود میگردد، تجزیه کیفی نامیده میشود، در حالی که اگر آزمایش به تعیین مقدار یک گونه خاص موجود در نمونه (تعیین درصد ترکیب در مخلوطها یا اجزای ساختمانی یک ماده خالص) محدود گردد، تجزیه کمی نامیده میشود. گاهی کسب اطلاعاتی در زمینه آرایش فضایی اتمها در یک مولکول یا ترکیب بلورین ضروری است، یا تاکید حضور یا موقعیت برخی گروههای عامل آلی در یک ترکیب مورد تقاضا است، چنین آزمایشهایی تحت عنوان تجزیه ساختمانی نامیده میشوند و ممکن است با جزئیاتی بیش از یک تجزیه ساده مورد توجه قرار گیرند.ماهیت روشهای تجزیهایروشهای تجزیهای معمولا به دو دسته کلاسیک و دستگاهی طبقه بندی میشوند. روشهای کلاسیک شامل روشهای شیمیایی مرطوب ، نظیر وزن سنجی و عیار سنجی است. در واقع تفاوت اساسی بین روشهای دو دسته وجود ندارد. همه آنها مشتمل بر وابستگی یک اندازه گیری فیزیکی به غلظت آنالیت میباشند. در حقیقت روشهای تجزیهای محدودی وجود دارند که صرفا دستگاهیاند و یا بیشتر آنها متضمن مراحل شیمیایی متعددی قبل از انجام اندازه گیری دستگاهی هستند.کاربردهای شیمی تجزیهکنترل کیفیت محصولبیشتر صنایع تولیدی نیازمند به تولید با کیفیت یکنواخت هستند. برای کسب اطمینان از برآورده شدن این نیازمندی مواد اولیه و همچنین محصول نهایی تولید ، مورد تجزیههای شیمیایی وسیعی قرار میگیرند.نمایش و کنترل آلوده کنندههافلزات سنگین پسماندههای صنعتی و حشره کشهای آلی کلردار ، دو مشکل کاملا شناخته شده مربوط به ایجاد آلودگی هستند. به منظور ارزیابی چگونگی توزیع و عیار یک آلوده کننده در محیط ، به یک روش تجزیهای حساس و صحیح نیاز است و در کنترل پسابهای صنعتی ، تجزیه شیمیایی روزمره حائز اهمیت است.مطالعات پزشکی و بالینیعیار عناصر و ترکیبات مختلف در مایعات بدن ، شاخصهای مهمی از بی نظمیهای فیزیولوژیکی میباشند. محتوی قند بالا در ادرار که نشانهای از یک حالت دیابتی است و وجود سرب در خون ، از شناختهترین مثالها در این زمینه میباشد.عیارگیریاز دیدگاه تجارتی در برخورد با مواد خام نظیر سنگهای معدنی ، ارزش سنگ معدن ، از روی فلز موجود در آن تعیین میشود. این موضوع ، مواد با عیار بالا را نیز غالبا شامل میشود. بطوری که حتی تفاوت کم در غلظت میتواند از نظر تجاری تاثیر قابل ملاحظهای داشته باشد. بنابراین یک روش تجزیهای قابل اعتماد و صحیح از اهمیت اساسی برخوردار است.آینده شیمی تجزیهبروز مشکلات تجزیهای در شکلهای جدیدش ادامه دارد. میزان تقاضای مربوط به انجام تجزیه در ابعاد وسیع توسط بسترهای دستگاهی بطور مداوم در حال افزایش است. کاوشهای فضایی ، نمونههای گمانه زنی و مطالعات اعماق دریاها مثالهایی از نیازهای قابل طرح میباشند. در دیگر زمینهها نظیر مطالعات محیطی و بالینی ، فرم شیمیایی و دقیق یک عنصر در یک نمونه و نه غلظت کلی آن ، اهمیت فزایندهای پیدا کرده است. دو مثال کاملا شناخته شده در این زمینه ، میزان سمیت بسیار زیاد ترکیبات آلی جیوه و سرب در مقایسه با ترکیبات مشابه معدنی است.
صفحه قبل 1 صفحه بعد
پيوندها
|
||||||
|
|